Особенности хелатных удобрений и способы их применения
Содержание:
- Что значит «хелатная форма»?
- Как приготовить хелат железа в домашних условиях?
- Хелатные комплексы
- Как не допустить ошибок?
- Медицинские приложения
- Формы и роль железа в растительных организмах
- Хелаты и органика
- Решение проблемы недостатка питательных веществ
- Действительно ли хелатные минералы усваиваются лучше?
- Откуда берутся ионы металлов в косметике и как они влияют на работу продукта?
- Поведение в почве
- Хелат железа собственного приготовления
- Удобрения, содержащие хелаты
- Хелатирующие шампуни
- Дигидрат диоксалатокупрат (ΙΙ) калия
Что значит «хелатная форма»?
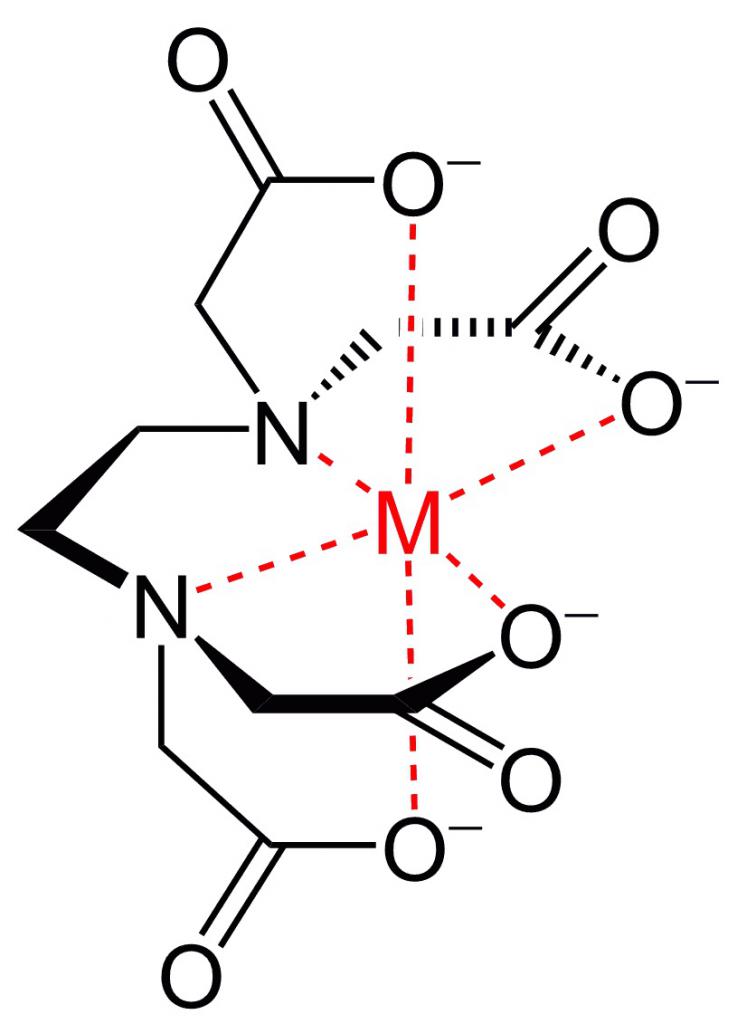
Хелаты представляют собой комплекс, который появляется в результате взаимодействия положительно заряженных ионов металла (центральный атом комплексообразователя) с лигандами, формирующими химические соединения с различными видами биомолекул. Проще говоря, хелаты – это сочетание минерала и сложного органического соединения. К лигандам относятся аминокислоты, пептиды, белки, пурины, порфирины, макролиды, а также их синтетические аналоги (краун-эфиры, криптанды).
У хелатообразующих лигандов должно быть более 2 функциональных групп, способных создавать ковалентные связи и кольцевую структуру с металлом. Слово «хелат» происходит от латинского chela («клешня»). Внешне форма этих химических соединений похожа на клешни краба, удерживающего минерал.
В природе наиболее яркими представителями этого типа соединений на порфириновой основе являются человеческий гемоглобин, где в качестве центра комплексообразователя выступает Fe (хелат железа), и хлорофилл (хелат магния). Современные биохимические технологии позволяют получить различные формы таких веществ.
Как приготовить хелат железа в домашних условиях?
Но вполне реально также приготовить раствор и самим, из подручных (всегда имеющихся в каждом доме) реактивов.
Для изготовления в домашних условиях можно прибегнуть к двум способам – созданию хелата из железного купороса и:
- лимонной кислоты;
- кислоты аскорбиновой.
Расчёт идёт на 1 л максимально чистой (желательно дождевой) воды.
В первом варианте в указанном объёме растворяют (последовательно) лимонную кислоту (4 г), затем – железный купорос (2,5 г) и размешивают до однородной окраски жидкости.
Второй отличается от первого только дозой веществ: железного купороса требуется 10 г, аскорбиновой кислоты – в 2 раза больше (20 г).
Способ применения полученного раствора зависит от степени срочности случая: когда нужно много и сразу – совмещают опрыскивание по листьям с корневой подкормкой, если нет – «прыщут» по листьям.
Следует помнить, что «самопальный» раствор хранению не подлежит, в то время как фирменный – хранится сколь угодно долго, если не давать ему замерзать, а самое главное – не допускать к нему вездесуще-пронырливых детей.
Хелатные комплексы
Бурятский государственный университет
Химический факультет
КУРСОВАЯ РАБОТА
Тема: Хелатные комплексы
Улан-Удэ
год.
Введение
Комплексные соединения представляют собой интересный класс веществ в
неорганической химии. Их природа представляет для науки большой интерес, так
как значительное количество элементов периодической системы могут образовывать
комплексы, как с другими элементами, нейтральными молекулами, так и с катионами
(анионами) кислотных (основных) остатков.
Особую группу составляют циклические комплексные соединения или хелаты.
Хелатную структуру имеют многие комплексы. Так, например молекула гемоглобина
представляет собой комплекс, который соединяет атом Fe(II) и
тетрадентатный хелатообразующий лиганд — порфирин. Этот лиганд образует
комплекс с магнием, который называется хлорофил.
Цель работы.
Основной целью данной работы является получение, изучение физических и
химических свойств хелатных комплексов. Интерес состоит в том, что хелаты по
отношению к другим комплексам обладают интересными свойствами: циклическое
строение, повышенная прочность. Еще одна причина по которой стоит изучать
хелатные комплексы — большинство органических комплексов в живой природе
относятся именно к ним. Так же в данной работе вообще затрагивается вообще вся
химия комплексных соединений и имена тех кто вложил большой вклад в изучение
комплексных соединений.
Задачи.
1) Подобрать теоретический материал.
2) Подобрать методики синтезов необходимых нам соединений.
) Повести синтез хелатных соединений
) Сделать выводы.
Глава первая.
Теоретическая часть
.1 Классификация комплексных соединений
Комплексные соединения (К.С.) — соединения образованные сложными
катионными и анионными составляющими единую структуру.
Применяется несколько видов классификаций комплексов:
По принадлежности к определенному классу соединений
Комплексные кислоты — H2[SiF6], H;
Комплексные основания — [Ag(NH3)2]OH, [Co(En)3](OH)3.
По природе лигандов
Если лигандом является вода, комплексы называются аквакомплексами,
например, [Co(H2O)6]SO4, [Cu(H2O)](NO3)2. Находящиеся в водном
растворе гидратированые катионы содержат в качестве центрального звена
аквакомплекс. В кристаллическом состоянии некоторые из аквакомплексов
удерживают и кристаллизационную воду, например: [Cu(H2O)4]SO4·H2O и др. Кристаллизационная вода не
входит во внутреннюю сферу, она связана менее прочно, чем координационная, и
легче отщепляется при нагревании.
Комплексы образованные аммиаком — аммиакаты, например[Ag(NH3)2]Cl, [Cu(NH3)4]SO4. Известны комплексы аналогичные
аммиакатам, в которых роль лиганда выполняют молекулы аминов: CH3NH2 (метиламин), C2H5NH2 (этиламин), NH2CH2CH2NH2 (этилендиамин, условно обозначаемый En) и др. Такие комплексы называют
аминатами.
Оксалатные, карбонатные, цианидные, галогенидные, и другие комплексы
содержащие в качестве лигандов анионы различных кислот, называются
ацидокомплексами. Например, K4[Fe(CN)6] и
K2[HgI4] —
цианидный иодидный ацидокомплексами,.
Соединения с OH-группами в виде
лигандов называют гидрокомплексами, например: K3[Al(OH)6].
По знаку заряда комплекса различают
Катионные комплексы — [Co(NH3)6]Cl3
анионные комплексы — Li[AlH4], K2[Be(CO3)2]
нейтральные комплексы — [Pt(NH3)2Cl2],
[Co(NH3)3Cl3].
Нейтральные комплексы не имеют внешней сферы. Более сложными являются бикомплексы,
состоящие из комплексных катионов и анионов, например [Co(NH3)6][Fe(CN)6].
Особую группу составляют сверхкомплексные соединения. В них число
лигандов превышает координационную валентность. Примером может служить CuSO4·5H2O. У меди координационная валентность
равна четырем и во внутренней сфере координированы четыре молекулы воды. Пятая
молекула присоединяется к комплексу при помощи водородных связей.
.2 Циклические или хелатные (клешневидные) комплексные соединения
Они содержат би- или полидентатный лиганд, (лиганды, образующие с
центральным атомом, две связи, называются бидентатными; образующие три связи —
тридентатные и т.д.) который как бы захватывает центральный атом подобно
клешням рака:
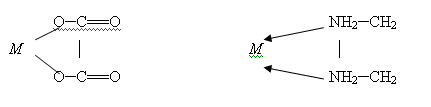
Как не допустить ошибок?
Чтобы эффективность от листовых подкормок была максимальной, необходимо учитывать ряд правил. В том числе, проводить опрыскивание вечером или утром, чтобы избежать испарения рабочего раствора с листовой поверхности. Скорость движения опрыскивающей техники должна быть небольшой, чтобы избежать сноса капель. Кроме того, незадолго до обработки рекомендуется проверить прогноз погоды на ближайшие несколько часов, чтобы избежать смыва препарата. Если соблюсти эти нехитрые правила, Лигногумат B-Fe и другие агрохимикаты данной линейки выполнят свои функции и создадут условия для формирования высоких, качественных урожаев.
Медицинские приложения
Пищевые добавки
В 1960-х годах ученые разработали концепцию хелатирования иона металла перед тем, как скармливать этот элемент животному. Они полагали, что это создаст нейтральное соединение, защищающее минерал от образования комплексов с нерастворимыми солями в желудке, что сделало бы металл недоступным для абсорбции. Аминокислоты, являющиеся эффективными связующими с металлами, были выбраны в качестве предполагаемых лигандов, и были проведены исследования комбинаций металл-аминокислота. Исследования подтвердили, что хелаты металл-аминокислота способны увеличивать усвоение минералов.
В этот период разрабатывались синтетические хелаты, такие как этилендиаминтетрауксусная кислота (ЭДТА). Они применили ту же концепцию хелатирования и создали хелатные соединения; но эти синтетические материалы были слишком стабильны и не питательны. Если бы минерал был взят из лиганда EDTA, лиганд не мог бы использоваться организмом и был бы изгнан. Во время процесса изгнания лиганд EDTA произвольно хелатировал и лишал организм другого минерала.
По данным Ассоциации американских чиновников по контролю кормов (AAFCO), хелат металл-аминокислота определяется как продукт, образующийся в результате реакции ионов металла из растворимой соли металла с аминокислотами с мольным соотношением в диапазоне 1– 3 (предпочтительно 2) моля аминокислот на один моль металла. Средняя масса гидролизованных аминокислот должна составлять приблизительно 150, а результирующая молекулярная масса хелата не должна превышать 800 Да .
С самого начала разработки этих соединений было проведено гораздо больше исследований, и они были применены к продуктам питания человека аналогично экспериментам по питанию животных, в которых впервые появилась эта технология. Бис-глицинат железа является примером одного из этих соединений, разработанных для питания человека.
Стоматологическое и оральное применение
Дентиновые адгезивы первого поколения были впервые разработаны и произведены в 1950-х годах. Эти системы основаны на хелате сомономера с кальцием на поверхности зуба и создают очень слабую водостойкую химическую связь (2–3 МПа).
Детоксикация от тяжелых металлов
Хелатотерапия — это противоядие от отравлений ртутью , мышьяком и свинцом . Хелатирующие агенты превращают ионы этих металлов в химически и биохимически инертную форму, которая может выводиться из организма. Хелатирование с использованием динатрия кальция EDTA было одобрено Управлением по контролю за продуктами и лекарствами США (FDA) для серьезных случаев отравления свинцом. Он не одобрен для лечения «отравления тяжелыми металлами».
Хотя это полезно в случаях серьезного отравления свинцом, использование динатрия ЭДТА (динатрия эдетата) вместо ЭДТА динатрия кальция привело к летальному исходу из-за гипокальциемии . Динатрий ЭДТА не одобрен FDA для любого использования, и все продукты хелатной терапии, одобренные FDA, требуют рецепта.
Фармацевтические препараты
Хелатные комплексы гадолиния часто используются в качестве контрастных агентов при МРТ-сканировании , хотя также изучались хелатные комплексы частиц железа и марганца . Бифункциональные хелатные комплексы циркония , галлия , фтора , меди , иттрия , брома или йода часто используются для конъюгации с моноклональными антителами для использования в визуализации ПЭТ на основе антител . В этих хелатных комплексах часто используются гексадентатные лиганды, такие как десфериоксамин B (DFO), согласно Meijs et al. , а комплексы гадолиния часто используют октадентатные лиганды, такие как DTPA, согласно Desreux et al . Ауранофин , хелатный комплекс золота , используется при лечении ревматоидного артрита, а пеницилламин , образующий хелатные комплексы меди , используется при лечении болезни Вильсона и цистинурии , а также рефрактерного ревматоидного артрита.
Другие медицинские приложения
Хелатирование в кишечном тракте является причиной многочисленных взаимодействий между лекарствами и ионами металлов (также известными как « минералы » в питании). В качестве примеров, антибиотические препараты этих тетрациклина и хинолонов семей Хелаторы Fe 2+ , Са 2+ и Mg 2+ ионов.
ЭДТА, которая связывается с кальцием, используется для облегчения гиперкальциемии, которая часто возникает в результате ленточной кератопатии . Затем кальций может быть удален из роговицы, что позволяет улучшить четкость зрения пациента.
Формы и роль железа в растительных организмах
Подобно животным организмам, растения накапливают железо, входящее в состав белковой молекулы ферритина. Кроме этого, элемент входит в структуру фермента каталазы, принимающего участие в высвобождении молекулы кислорода при дыхании или накоплении отрицательно заряженного кислородного радикала.
Без железа не обходится образование молекул АТФ и энергетический обмен клеток.
Как уже упоминалось, железо активирует синтез хлорофилла, входя в состав ферментов-переносчиков транспортной цепи электронов.
В процессе фотосинтеза электроны движутся в направлении цитохромного комплекса, в составе которого также присутствует железо, в то время как в мембранах хлоропластов, где происходит образование органических веществ с высвобождением кислорода, содержится сульфат железа и протеин сульфида железа – ферридоксин (Н-редуктаза).
В процессе образования энзимов, они же – нитрат- и нитритредуктазы, а также фосфороредуктаза и нитрогеназа активно используют железосодержащие компоненты.
Как видим, роль железа в растительном организме велика. Этот элемент нужен культурам в меньшем объеме, чем азот, фосфор и калий, но в большем, чем, например, селен или йод, хотя его также относят к микроэлементам.
Хелаты и органика
Хелатированные удобрения вполне применимы в органическом земледелии или в процессе перехода к нему, т.к. исключают залповый выброс в почву активных агентов, нарушающих сложившийся в ней биоценоз. Исключение – заправка почвы натуральным перепревшим (не гранулированным) навозом, навозные парники, теплицы и теплые грядки. Эти способы использования земли сами по себе обеспечивают в ней должный баланс гуматов и фульватов. Избыток хелатов его нарушит, что может вызвать выщелачивание и защелачивание почвы. Если навозная заправка открытого грунта производилась осенью, хелаты на этой площади применимы с весны; если же заправка было весенняя – на следующий сезон. А вот вносить хелатированное питание растений после птичьего помета можно уже через месяц, поскольку помет птиц не влияет коренным образом на баланс почвенных кислот.
2014-2021 Удобрения.Инфо
Решение проблемы недостатка питательных веществ
Хорошим решением этой проблемы является применение некоторых микроэлементов в форме хелатов. Они образуются химическим путем в виде соединения хелатизирующего вещества (лиганда) с катионом металла (например, Fe, Mn, Zn, Cu). Образно говоря, отдельная частица метала окружена большой частицей хелатизирующего вещества и закреплена несколькими химическими соединенями (название «хелат» происходит от греческого слова «chele», что означает клещи краба или шипцы).
Хелатизирующие вещества принадлежат к группе комплексирующих веществ, которых существует около 450.
Не все микроэлементы могут быть хелатизированы. Например, невозможно хелатизировать бор или молибден. Эти микроэлементы не имеют химических соединений, которые могли бы присоединить хелатизирующее вещество. Поэтому они присутствуют в удобрениях только в форме неороганиеских солей.
Согласно Директиве ЕС 2003/2033 только несколбько хелатизирующих веществ допускается применать в сельском хозяйстве. Хелаты этих соединений имеют высокую прочность. В список Европейской Комиссии хелатизирующих веществ включены: EDTA, DTPA, EDDHA, HEEDTA, EDDHMA, EDDCHA, IDHA, HBED. Причем на практике применяются только некоторые из них. Например, вещество EDTA присутствует на рынке уже 60 лет и чаще всего используется для хелатизации.
Самая важная черта хелатизирующих веществ это постоянная прочности (рК), которую принято называть мощностю хелата.
Постоянная прочности – показатель всех хелатизирующих веществ, хотя самые простые их них (например, лимонная кислота) образуют слабые, легко распадающиеся комплексные соединения. Чем выше постаянная прочности хелата (рК) тем он более устойчив при высоком рН среды (не разлагается до хелатизирующего вещества и металла в форме гидроокиси).
На практике – чем мощнее хелат, тем выше его цена.
На примере катиона Fe+3 можно приблизительно определить пределы рН почвы при котором экономически обосновано применение определенных продуктов:
- EDTA и IDHA при рН
- DTPA при рН 6,5 — 7,5
- EDDHA и HBED при рН > 7,5
Поэтому самые мощные (и самые дорогие) хелаты (HBED) стоит применять в самых сложных условиях (например, при известковых почвах).
Свойства хелатов:
- легкая усвояемость растениями
- прочность (стабильность) – микроэлементы остаются в формах, пригодных для усвоения растениями при широком диапозоне рН
- защищенность микроэлементов от дестабилизации другими факторами (например, соединениями фосфора)
- более медленное вымывание из почвы
- меньший риск фитотоксичности для культуры
- разная форма удобрений – кристаллическая (микрокристаллы) и жидкая
- легкая и быстрая расторимость в воде
- применение в виде некорневой подкормки, почвенного удобрения, при фертигации и гидропонике
- возможность совместного применения с пестицидами и другими удобрениями (с учетом рекомендации производителя удобрений)
Действительно ли хелатные минералы усваиваются лучше?
Хелатные минералы часто рекламируются как имеющие лучшую абсорбцию, чем нехелатные.
Несколько исследований сравнивали усвоение двух.
Например, исследование с участием 15 взрослых показало, что хелатный цинк (в виде цитрата цинка и глюконата цинка) усваивается примерно на 11% более эффективно, чем нехелатный цинк (в виде оксида цинка) ().
Аналогичным образом, исследование, проведенное с участием 30 взрослых, показало, что глицерофосфат магния (хелатный) повышает уровень магния в крови значительно больше, чем оксид магния (не хелатный) ().
Более того, некоторые исследования показывают, что прием хелатных минералов может снизить общее количество, которое вам нужно принимать для достижения здорового уровня в крови
Это важно для людей, подверженных риску избыточного потребления минеральных веществ, таких как перегрузка железом
Например, в исследовании, проведенном на 300 новорожденных, суточная доза 0,75 мг на кг массы тела бисглицината железа (хелатное) ежедневно, повышала уровень железа в крови до уровня, аналогичного тому, который вызывается в 4 раза большим количеством сульфата железа (не хелатное) ().
Тем не менее не все исследования дают одинаковые результаты.
Исследование, проведенное с участием 23 женщин в постменопаузе, показало, что 1000 мг карбоната кальция (не хелатного) быстрее усваивается и повышает уровень кальция в крови более эффективно, чем такое же количество цитрата кальция (хелатного) ().
Между тем, исследование с участием беременных женщин с дефицитом железа не выявило существенных различий в уровнях железа в крови при сравнении хелатного железа (бисглицината железа) с обычным железом (сульфатом железа) ().
В целом, исследования на животных показывают, что хелатные минералы усваиваются более эффективно (, ).
Однако эти результаты следует интерпретировать с осторожностью, поскольку пищеварительные тракты животных значительно отличаются от пищеварительных трактов людей. Эти различия могут влиять на усвоение минералов
Учитывая, что текущие исследования носят смешанный характер, необходимы дополнительные исследования хелатных минералов.
Откуда берутся ионы металлов в косметике и как они влияют на работу продукта?
Следы ионов металлов можно обнаружить почти везде, при этом даже незначительное их количество может вызвать изменение цвета и свойств продукта. Даже при идеальных производственных условиях ионы металлов могут попасть в косметику с оборудования, контейнеров для хранения, систем водоснабжения или натуральных косметических компонентов. И если их количество не корректировать, могут происходить медленные реакции внутри упаковки с продуктом, что приведет к его порче. Так, например:
- некоторые отдушки, могут изменять запахи и разлагаться,
- витамины и незаменимые жирные кислоты могут разлагаться,
- со временем могут меняться цвета продуктов,
- жиры могут прогоркать,
- прозрачный продукт может становиться мутным,
- однородные косметические составы могут расслаиваться,
- окислители и активаторы могут становиться нестабильными.

Косметические продукты с хелатирующими веществами
Также ионы металлов приводят к тому, что моющие и ополаскивающие средства, значительно хуже пенятся, особенно в жесткой воде.
При окрашивании волос ионы металлов могут мешать полезным реакциям перекиси водорода, уменьшать стойкость цвета окрашенных волос и даже способствовать разрушению пигментов. А при работе осветляющих веществ ионы металлов, могут давать нежелательные оттенки на блонде и мешать процессу осветления.
Поведение в почве
Удобрения на хелатной основе применяются в основном поливом под корень и для подкормок по листьям; реже – в форме водорастворимых гранул или микрокапсул. Плодородная почва – среда влажная, слабокислая или слабощелочная; нейтральные почвы с pH=(6,5-7,5) встречаются как исключение. Вследствие общих свойств хелатов (см. выше) поведение в ней хелатных удобрений существенно отличается от такового солевых.
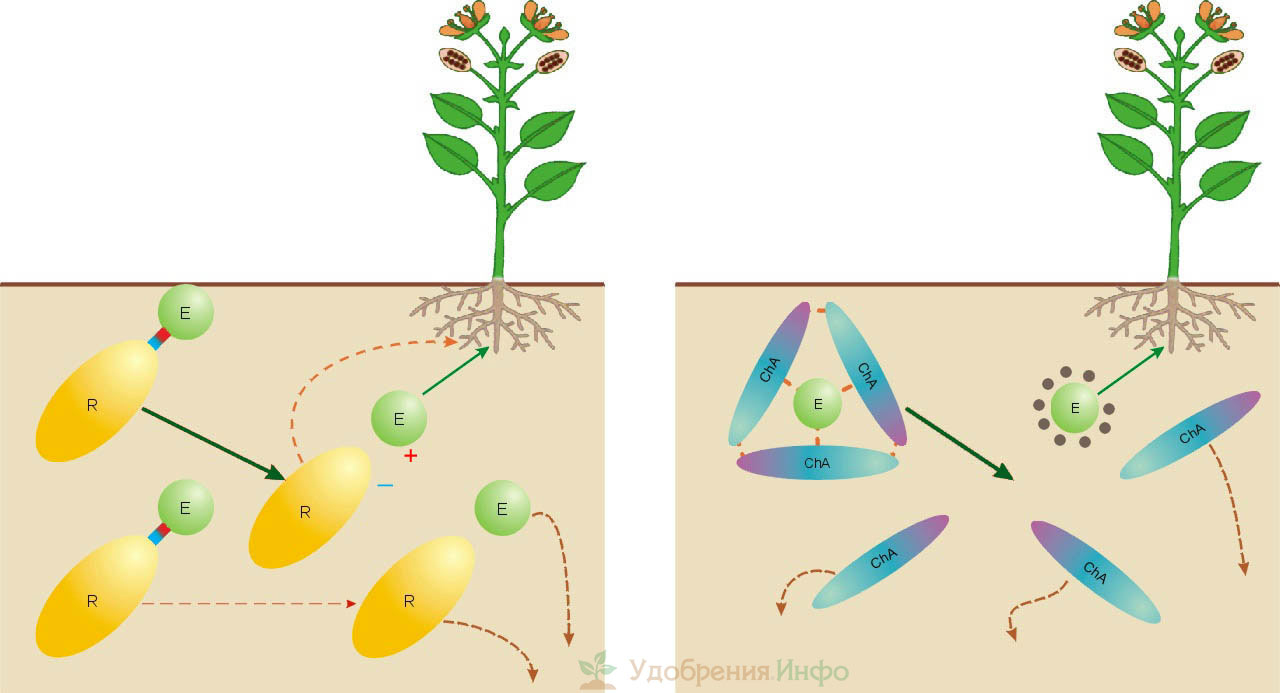
Поведение в почве солевого минерального и хелатного удобрения
Солевое удобрение во влажной среде (слева на рис.) немедленно диссоциирует на ионы питательного элемента и остатка. Последний также может содержать питательные элементы или микроэлементы, напр., в калиевой селитре, суперфосфате, калимагнезии, сульфате магния и др. Поскольку ионы весьма подвижны, часть элементов питания неизбежно теряется. Диссоциация это просто-напросто залповый выброс. Концентрация ионов поначалу оказывается слишком высокой, что и понуждает их «разбредаться» как можно скорее. Оказывается возможной ситуация, когда растения недокормлены, а почва вне их объемов питания перенасыщена удобрением, что никак не идет на пользу экологии. Если дозировать внесение по максимуму, то вероятны и химические ожоги корней, и накопление посторонних веществ в плодах (чаще всего – нитратов).
Хелатные соединения в почве не диссоциируют, а распадаются на компоненты (справа на рис. выше) прежде всего под влиянием кислотности среды. Распад хелатов идет постепенно, т.к. кислотность почвы обусловлена гуминовыми веществами (ГВ). Расходуются на него почвенные кислоты, в первую очередь фульвовые. Кислотность падает, распад хелатов замедляется, но интенсифицируются процессы образования ГВ. Это снова провоцирует распад хелатов и т.д. Благодаря такому динамическому равновесию питательный элемент выделяется со скоростью, как бы «приноравливающейся» к текущим условиям. В результате вероятность ожогов корней и перекармливания растений уменьшается многократно.
Затем, катионы элемента питания, «не видя» анионов-партнеров, образуют комплексные соединения с другими почвенными кислотами – малоподвижными гуминовыми. Микроток в плодородном слое направлен к «насосам» – корням. Гуматы концентрируются в корневом коме, а вне объема питания их концентрация падает. Это по законам химического равновесия сдвигает почвенные процессы в сторону образования гуминовых кислот. Подвижные фульвовые связываются остатками лигандов и теряют способность быстро и далеко «растаскивать» питательные вещества. В целом же почва лучше сохраняет плодородие и меньше выщелачивается.
EDTA или «лимонка»?
Хелаты на слабых агентах в достаточно тучных и увлажненных почвах распадаются очень быстро. Удобрения на их основе в таких условиях применимы для лечебных (напр. от хлороза) или срочных питательных подкормок, но в качестве текущих сезонных мало эффективны, а вероятность перекармливания растений приближается к таковой минеральными солями.
Удобрения, хелатированные EDTA, на кислых и слабокислых почвах дозируют выделение элементов питания вполне приемлемо. Но один из продуктов их распада – этилен. Этот легкий газ – фитогормон, ускоряющий созревание плодов. Что и может произойти в ущерб их товарным качествам – крупности, сочности, вкусу. В общем, на своем участке начинать применение хелатных удобрений нужно с минимальных рекомендованных инструкцией доз, а далее вносить проверенные.
Хелат железа собственного приготовления
Легко сделать хелат железа своими руками в домашних условиях двумя народными способами:
- Развести в 1 литре воды 10 г железного купороса (не путать с медным). Добавить 20 г аскорбиновой кислоты. Опрыскивать и поливать этим раствором хлорозные растения.
- В одном литре воды развести половину чайной ложки лимонной кислоты. Добавить 2,5 г железного купороса. Получается светло-оранжевая жидкость, содержащая комплексную соль двухвалентного железа. Этот раствор используют для опрыскивания и полива растений.
Срок годности самодельного хелата железа составляет 2 недели.
Одним из нетрадиционных и очень распространённых методов борьбы с хлорозом в домашних условиях является закапывание в горшок с растением ржавых гвоздей. Здесь главное — наличие ржавчины.
Всегда лучше действовать на опережение, чтобы предотвратить недуг с помощью своевременной подкормки и качественного ухода.
Я беру хелат железа в ампулах, жидкий и разбавляю в 0,5-литровой бутылке, наливаю в пульверизатор и обрабатываю растения, когда нет солнышка. Действует достаточно эффективно
Я в грунт добавляла вермикулит с микроэлементами, убивающими хлороз. Растение при этом можно не пересаживать, достаточно убрать верхний слой почвы и добавить почву с вермикулитом. Феровитом, содержащим железо, подкармливают растение под корень. Я лично пользовалась феровитом и результатом очень довольна.
Могу рассказать из собственного опыта, как лечил пассифлору. После внесения комплекса удобрений с большим содержанием азота заметил, что листья на растении стали скручиваться. Полил комплексным раствором с содержанием: марганца -4,2%, железа-8,14%;медь -0,5%;бор-1,6%, цинк -1,0%кобальт-0,2%, молибден -0,1%. Улучшения были заметны уже через день. На листьях практически пропали хлоротичные пятна, они развернулись.
Весна в самом разгаре, большинство цитрусовых тронулись в рост, мандарин Уншиу покрылся бусинами бутонов, лимон Лунарио тоже выпускает новые точки бутонов, одновременно подращивая, разные по возрасту и размеру, плоды лимончиков. На всем этом зеленом фоне особенно выделяются светло-желтыми оттенками молодой прирост каламондина, тронувшаяся в рост прививка грейпфрута и листва кумквата Нагами. Что это? Господин Хлороз пожаловал?
Давайте будем разбираться вместе. Хлороз — это распространенное заболевание растений, проявляющееся в нарушении образования хлорофилла в листьях. При этом пластина листа желтеет, а прожилки остаются зелеными.
Основная причина, вызывающая хлороз, осветление листьев это нехватка растению железа. Из-за чего же она возникает? Я бы выделила три основных причины:
- Закисание почвы в горшке в результате неправильного полива и, как следствие, нарушение усвоения растением питательных веществ корнями.
- Размер горшка стал тесен, корни разрослись и почва уже отдала все свои полезные запасы.
- Вирусная инфекция.
Теперь рассмотрим каждое растение по порядку. Каламондин с молодым приростом. Оказывается, это довольно распространенное явление, когда молодой прирост растёт более светлым, чем остальные листья. Хотя, считаю, что в моем случае и горшок уже маловат, пора переваливать в «квартиру» чуть больше.
Прививке грейпфрута возможно не хватает хорошей корневой, поскольку из-за нехватки хороших подвоев, она была выполнена на укоренявшийся черенок лимона Пандерозы, а грейпы имеют довольно мощный рост. Тут остается только ждать, когда подвой нарастит корневую и сможет полноценно обеспечивать крону.
А вот кумквату явно нужно помочь, поскольку этот малыш выносил первый свой урожай в пять плодиков. Конечно, нельзя было его так нагружать, но, каюсь, очень уж хотелось «в живую», а не на картинке увидеть плоды этого цитруса. Его я перевалю в чуть больший горшок. Ну и все растения с признаками хлороза я обрабатываю Феровитом.
Удобрения, содержащие хелаты
Однокомпонентные – содержащие один хелатизированый элемент (Fe, Mn, Zn, Cu, Ca или Mg)
Многокомпонентные – смеси хелатов, содержащие несколько хелатизированных элементов (Fe, Mn, Zn, Cu, Ca или Mg).
Многокомпонентные смеси хелатов с не хелатными элементами (например, с NPK, Mg, Ca, B, Mo или Co).
Удобрения-смеси производятся под конкретные потребности для конкретных условий (локальные свойства почвы, недостаток каких-либо питательных веществ), а также под требования растений в зависимости от фаз их развития и роста.
Такие удобрения доступны в двух формах – blend (смесь) или compound (соединение).
Первое (blend) – это физическая смесь некоторых кристаллических удобрений, содержащих отдельные элементы. Это неоднородная смесь, заметны отдельные гранулы разного цвета.
Второе (compound) – это химическая смесь, образованная из нескольких жидких удобрений, содержащих отдельные элементы. В результате сушки и грануляции получается удобрение с однородным цветом и размером гранул
Важно то, что все гранулы однородны и с химической точки зрения.
Так что два удобрения в формах blend и compound могут быть идентичны по составу, но различаться внешне.
Хелатирующие шампуни
Хелатирующие шампуни предназначены для удаления избытков солей металлов с волос. Это шампуни с повышенным содержанием веществ, которые образуют хелаты с ионами металлов в волосах. В результате их применения минеральные накопления быстро вымываются и не мешают парикмахерским процедурам.
Это относительно новая группа шампуней. Их можно встретить только у отдельных брендов, например, Joico K-Pak Chelating Shampoo или L’ANZA Ultimate Treatment Chelating Shampoo.
Чем отличаются хелатирующие шампуни от шампуней глубокой очистки?
Очень часто шампуни глубокой очистки и хелатирующие шампуни путают и пытаются взаимозаменять, но нужно понимать, что все же это разные продукты и они не могут на 100% заменить друг друга.
Обычные шампуни глубокой очистки в основном работают с остатками косметики на волосах и жировыми накоплениями, однако если в волосах накопились соли после морской воды, то шампуни глубокой очистки малоэффективны. Приходится многократно мыть волосы или ждать пару недель, пока накопления вымоются естественным путем.
Хелатирующие шампуни — по факту это шампуни с повышенным содержанием веществ, которые образуют хелаты с ионами металлов в волосах, и как следствие эти минеральные накопления быстро вымываются и не мешают парикмахерским процедурам.

Хелатирующий шампунь Joico K-Pak Chelating Shampoo
Представьте, пришел клиент на окрашивание или завивку после отдыха на море, где, благодаря морской воде, его волосы набрали огромное количество минеральных солей. Эти соли будут мешать проведению всех процедур. Шампунь глубокой очистки только разрыхлит волосы и может за 1—2 применения не вымыть все минеральные накопления, а вот хелатирующий шампунь справится быстро и эффективно. И далее при нанесении краски или составов для химической завивки ничего не будет мешать работе продуктов.
Следует знать, что хелатирующим шампунем вымываются только минеральные соли, которые привнесены извне — сам шампунь особо не влияет на структуру и состав волоса, и в отличии от шампуней глубокой очистки он имеет более мягкую моющую композицию, гораздо меньше разрыхляет волосы и хуже вымывает накопления косметики на волосах.
Дигидрат диоксалатокупрат (ΙΙ) калия
K2[Cu(C2O4)2]·2H2O
В термостойкий химический стакан ёмкостью 100 мл помещаем навеску
пентагидрата сульфата меди (ΙΙ) массой 5 г. и растворяем в 10 мл
воды (раствор Ι). Помещаем в другой химический стакан ёмкостью 100 мл
моногидрат оксалата калия массой 7,3 г и растворяем в 20 мл воды (раствор ΙΙ) и нагреваем оба раствора до 90оС.
Не охлаждая растворов, приливаем при интенсивном перемешивании раствор Ι к раствору II. После этого полученный раствор охлаждаем в водяной бане до
10С (внося в воду лёд).
Реакция синтеза

Рассчитываем количество вещества исходных компонентов, и по недостатку
определяем теоретический выход продуктов реакции:
Находим выход по CuSO4, т.к. он
находится в недостатке:
Полученный продукт просушил и взвесил, масса (K2[Cu(C2O4)2]) = 6,8 г.
Рассчитаем практический выход в % по отношению к теоретическому:
г — 100%
,8 г — Х%
Следовательно найдём выход
Проведем качественные реакции:
1) K2[Cu(C2O4)2] + 2NaOH(k) → Cu(OH)2↓
+ Na2C2O4 + K2C2O4 ( ион Cu2+)
Выпадает синий осадок гидроксида меди.
2) K2[Cu(C2O4)2]
+ Na3[Co(NO)2]→ K2Na[Co(NO2)6]
↓+ Na2C2O4 + (на ион K+)
Желтый осадок
Обесцвечивание раствора, выделение газа.
Снимаем спектр поглощения 0,01М раствора K2[Cu(C2O4)2]·2H2O(l=10мм)
|
№ |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
|
λ |
315 |
364 |
400 |
440 |
490 |
540 |
590 |
670 |
750 |
|
D |
0,07 |
0,11 |
0,15 |
0,21 |
0,32 |
0,51 |
1,3 |
0,8 |

График№2
Спектра поглощения раствора K2[Cu(C2O4)2]
.3
Синтез №3
Получение
триоксалатоферрата(III) калия
K3[Fe(C2O4)3]
Цель:
получить хелатный комплекс калия и железа
Приборы и посуда:
1. Стаканы химические (V=100мл)
2. Весы
. Водяная баня
. Мерный цилиндр
. Фильтры бумажные
. Воронка Бюхнера, колба Бунзена
. Водоструйный насос
. Шпатель, стеклянная палочка
. Бюкс
Реактивы:
1. Дигидрат
хлорида бария BaCl2·2H2O
. Оксалат
натрия Na2C2O4
. Сульфат
железа (III)
. Этанол
. Вода
дистиллированная
Ход работы:
Вначале приготовим оксалат бария, для чего к раствору 1.5 г оксалата
натрия в 40 мл воды приливаем раствор 2,5г хлорида бария в 6мл воды. Происходит
выпадение кристаллов,


Теоретический выход 2,3
Практический
выход 1,2 или то есть 52%.
Далее
полученный оксалат бария, сульфат железа(1,25 г.) и оксалат калия(1,5 г.)
помещаем в стакан и добавляем 30мл. воды. Полученный раствор нагреваем на
водяной бане в течении 2-х часов поддерживая постоянный объем. Происходит
реакция:

Раствор
фильтруем и упариваем до объема 5мл и охлаждаем при комнатной температуре.
Происходит выпадение зеленоватых кристаллов. Отсасываем их на воронке Бюхнера и
немедленно помещаем в темное место для сушки.
Взвешиваем
получившиеся кристаллы, их масса равна 1,4г.
n(BaC2O4)=моль
n(3К2C2O4)моль
n(Fe2
(SO4)3 ) моль
Находим
теоретический выход по оксалату калия так как он в недостатке.
,5
→ х
498 → 874
Практический
выход равен 1,4 или 53%.
Проведем
качественные реакции:
)
K3[Fe(C2O4)3]+ Na3[Co(NO2)6]
→ K2Na[Co(NO2)6]↓
(на ион К+)
желтый
осадок
)
K3[Fe(C2O4)3]+
Снимаем
спектр поглощения 0,01М раствора K3[Fe(C2O4)3] (l=10мм)
|
№ |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
|
λ |
315 |
364 |
400 |
440 |
490 |
540 |
590 |
670 |
|
D |
0,13 |
0,415 |
0,025 |

График №3
Спектра поглощения раствора K3[Fe(C2O4)3]
Заключение
В
результате проведения данной курсовой работы мы рассмотрели циклические
комплексы, изучили со стороны теории комплексных соединений, дав теоретическое обоснование
их химической и физических свойств; провели синтез представителей данного
класса веществ: триоксалатоферрат(III) калия K3[Fe(C2O4)3]
, диоксалатокупрат (II)калия K2[Cu(C2O4)2]·2H2O,
хлорид трисэтилендиамин кобальта III, подтвердили их качественный состав, сняли
спектры поглощения 0, 01 молярных растворв.
хелатный комплекс вещество химический
Список литературы
1. Васильев В.П. Аналитическая химия. Учеб. для студ.
вузов. 2-е изд., перераб и дополненное — М.: Дрофа, 2002. — 368с.: ил.
2. Желиговская Н.И., Черняев И.И., Химия комплексных
соединений. М.: Высшая школа, 1966. — 340с.
. Третьяков Ю.Д. Неорганическая химия, Т.2: Химия
непереходных элементов: Учебник для студ. высш. учеб. — М.: Издательский центр
«Академия», 2004. — 368с.
. Третьяков Ю.Д. Неорганическая химия, Т.2:
Физико-химические основы неорганической химии: Учебник для студ. высш. учеб. —
М.: Издательский центр «Академия», 2004. — 240с.
. Кнорре Д.Г. Физическая химия: Учебник для студ.
высш. учеб. — М.: Высшая школа 1990. — 416с.: ил.
. Угай Я.А. Общая и неорганическая химия: Учеб. для
вузов 3-е изд., испр. — М.: Высшая школа 2002. — 527с.: ил.
. Третьяков Ю.Д. Практикум по неорганической химии:
Учеб. пособие для студ. высш. уч. заведений. М.: Издательский центр «Академия»,
2004. -384с.:ил.
. Зломанов В.П. Практикум по неорганической химии:
Учеб. пособие. — М.: МГУ, 1994. — 320с.: ил.